Paul Lopolito, Elizabeth Rivera, STERIS Corporation, Life Science Division
Beseitigung mikrobieller Kontamination in Prozessanlagen
Einführung:
Die mikrobielle Kontamination wird als Risikoquelle für den Verbraucher angesehen. Das Vorhandensein unzulässiger Mikroorganismen in unsterilen Produkten bzw. jeglicher Art von Mikroorganismen in sterilen Produkten deutet auf unzureichende Prozesskontrollen hin. Für die Kontrolle mikrobieller Verschmutzungen ist die Zusammenarbeit in einer disziplinübergreifenden Gruppe erforderlich, damit Grundursachen ermittelt und Abhilfemaßnahmen in die Wege geleitet werden können.
Zweck:
In diesem Artikel werden Informationen gesammelt, die bei dieser Untersuchung helfen. Außerdem wird ein ganzheitlicher Ansatz zur Beseitigung mikrobieller Kontaminationen in Prozessanlagen vorgestellt.
Teil I: Vor der Untersuchung durchzuführende Arbeiten:
Folgende Informationen müssen bei der Prüfung vor der Untersuchung beschafft werden: Ermittlung der Mikroorganismen (Gattung und Kultur); Historie der Mikroorganismen vor Ort; Prozess-, Mitarbeiter- und Abwasserflussdiagramme; technische Zeichnungen; Methoden zur Anlagenreinigung und -desinfizierung. Durch das Verinnerlichen dieser Informationen kann ein Prüfer die intrinsischen und extrinsischen Quellen untersuchen. Als intrinsisch werden die für den Produktionsprozess oder die Anlage wesentlichen Quellen bezeichnet. Extrinsische Quellen hingegen stehen im Zusammenhang mit einer Übertragung in das Produkt über die Luft, Flüssigkeiten oder Oberflächenberührung. Historische Daten zu vorherigen mikrobiellen Kontaminationen können dabei helfen, nachzuvollziehen, ob die Kontamination wegen eines einzelnen Vorfalls oder aufgrund von ungenügenden Methoden bzw. unzureichenden Kontrollen auftrat.
Mikrobielle Kontaminationen können aus einer Vielzahl von Quellen stammen (Abbildung 1), einschließlich gramnegativer und grampositiver Bakterien, Mykobakterien, Mykoplasmen, Viren und Pilzen (Schimmel- und Hefepilze). Bakteriensporen sind aufgrund ihrer hohen Widerstandsfähigkeit ebenfalls problematisch. Gramnegative Bakterien stehen in Prozesssystemen oder Betriebsversorgungen häufig im Zusammenhang mit Biofilmen. Das Auftreten von Biofilmen zieht oft eine Anpassung der Reinigungsmethode nach sich, damit die Verunreinigung wirksam entfernt wird.
Teil II: Untersuchung:
Bei der Untersuchung müssen mögliche Ursachen einer mikrobiellen Kontamination bedacht und Hochrisikobereiche in den Mittelpunkt gestellt werden.
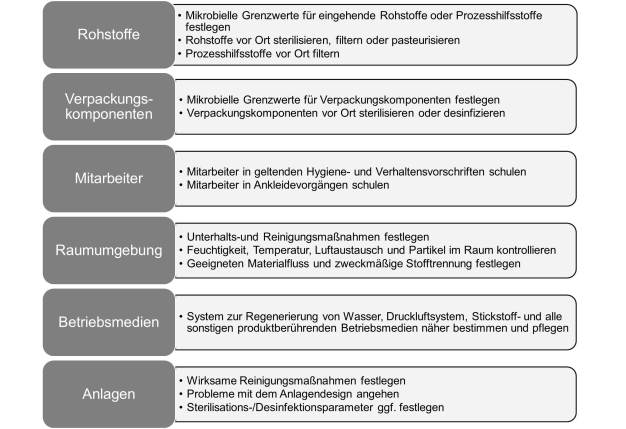
Rohstoffe, Prozesshilfsstoffe und Verpackung
Für jeden Rohstoff von jedem Lieferanten sollte eine Bewertung auf mikrobielle Risiken durchgeführt werden. Eine Reduktion der Mikroorganismen auf bzw. in Rohstoffen kann vor der Verwendung ggf. durch Pasteurisation, Filterung oder Sterilisation erreicht werden. Sämtliche Änderungen bei Rohstoffen oder Produktformeln müssen untersucht werden. Lagerung, Probenentnahme und Dispension von Rohstoffen müssen auf ein mögliches Eindringen von Mikroorganismen untersucht werden. Für sämtliche beim Produktionsprozess verwendeten Prozesshilfsstoffe oder Verpackungskomponenten muss ebenfalls eine Bewertung auf mikrobielle Risiken durchgeführt werden.
Kontrolle der Mitarbeiter und der Raumumgebung
Mitarbeiter sind die größte Quelle lebensfähiger und nichtlebensfähiger Partikel. Die Kontamination mit lebensfähigen und nichtlebensfähigen Partikeln über die Mitarbeiter wird über die Überwachung des Zugangs und der Kleidung sowie das Anbieten strenger Schulungen für Ankleidevorgänge und angemessenes Raumreinigungsverhalten kontrolliert. Weitere Umgebungs-kontrollen umfassen die Auswahl der Prozessanlagen sowie Reinigungs- und Desinfektions-methoden (Bartnett, 2007, und USP 1072).
Betriebsmedien (Wasser, Dampf, Druckluft und Gase)
Sämtliche direkt produktberührenden Betriebsmedien müssen untersucht werden. Testergebnisse der Routineüberwachung und Methoden der Kontaminationskontrolle müssen geprüft werden. Dazu können routinemäßige mikrobielle, TOC- (Total Organic Carbon = gesamter organischer Kohlenstoff) und Endotoxin-Tests zählen. Filter und UV-Lampen müssen gemäß den Herstellerempfehlungen ausgetauscht werden. Typische Maßnahmen zur Keimreduzierung bei Wassersystemen umfassen die Destillation, Filterung und/oder UV-Behandlung. Druckluft und Gase müssen vor der Verwendung gefiltert werden, damit lebensfähige und nichtlebensfähige Partikel, Öl sowie Kondenswasser nicht in das Prozesssystem gelangen. Nicht produktberührende Betriebsmedien wie Kühl- und Heizsysteme sind auf eine mögliche Kreuzkontamination des Produkts oder der Kontaktflächen des Produkts zu untersuchen.
Prüfen des Prozesses, der Mitarbeiter und des Abwasserflusses
Es ist wichtig, den Produktionsprozess zu prüfen und zu beobachten, wie die einzelnen Rohstoffe, Versorgungsgüter und Prozesshilfsstoffe eingesetzt oder dem Produkt ausgesetzt werden. Der Prüfer kann so mögliche intrinsische und extrinsische Risiken bewerten und Kontrollen prüfen. Mitarbeiter aus der Qualitäts-, Entwicklungs- und Betriebsabteilung sollten den Prüfer begleiten, um Fragen direkt klären zu können. Fotos und zusätzliche Probedaten außerhalb routinemäßiger Umgebungs- und Produktproben helfen beim Herausfinden von Veränderungen bei den Kontaminationskontrollmethoden.
Prozessanlage und mikrobielle Dekontamination
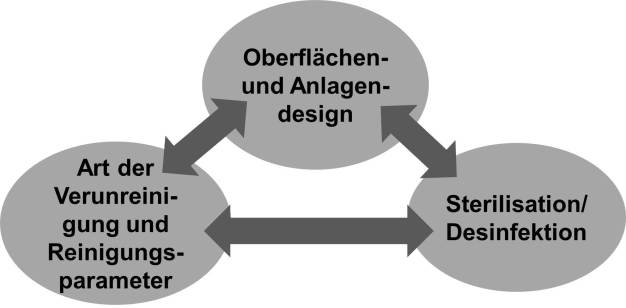
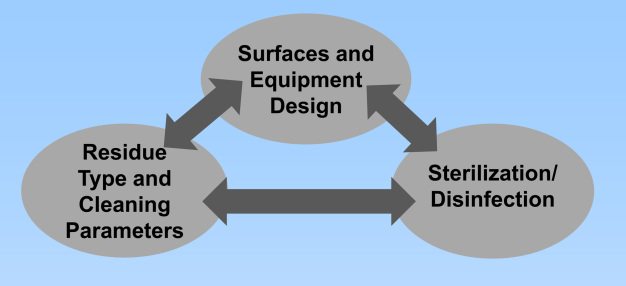
Die Hauptelemente, die bei der mikrobiellen Kontamination in Prozessanlagen berücksichtigt werden müssen, sind Oberflächen- und Anlagendesign, Art der Verunreinigung und Reinigungsparameter sowie Sterilisation/Desinfektion. Defizite bei einem Element haben möglicherweise starke Auswirkungen auf die anderen und umgekehrt. (siehe Abbildung 2)
Art der Verunreinigung und Reinigungsparameter
Ein wirksamer Reinigungsprozess ist für die mikrobielle Kontrolle essenziell. Tatsächlich ist für viele Biozid-Produkte vor der Anwendung eine saubere, verschmutzungsfreie Oberfläche erforderlich, da ansonsten die mikrobielle Wirksamkeit beeinträchtigt wird.
Prozessänderungen bei Fertigungsschritten, der Chargenzusammensetzung, der Haltezeit bei Verschmutzung, Rohstoffquellen, Umgebungsfaktoren und anderen Elementen können sich auf den Zustand der Verschmutzung zum Zeitpunkt der Reinigung auswirken. Wenn Änderungen eingeführt wurden, sollten Laborauswertungen durchgeführt werden, um die Eignung des aktuellen Reinigungsprozesses zu validieren. Dafür werden die vier Schlüsselparameter zur Bestimmung der Reinigungswirksamkeit getestet. Diese Parameter umfassen die Einwirkzeit der Reinigungslösung auf der verschmutzten Oberfläche, die auf der Oberfläche ausgeübte Aktion bzw. die aufgewendete Kraft, die Konzentration des Reinigungsmittels und die Temperatur der Reinigungslösung [Verghese, 2009]. Wenn die Verunreinigung auf der Oberfläche eingetrocknet, eingebacken, autoklaviert oder polymerisiert wurde bzw. denaturiert ist, ist es außerdem wichtig, die vorherrschenden Bedingungen zum Zeitpunkt der Reinigung nachzuahmen, einschließlich der Schmutzmenge auf der Oberfläche, der Hartnäckigkeit der Schmutzanhaftung und die Ausbreitung der Verschmutzung in der Reinigungslösung während des Reinigungsvorgangs.
Bei der Untersuchung auf mikrobielle Kontaminationen sollten auch Laborauswertungen verwendet werden. Eine Laborstudie hilft sowohl bei der Ermittlung von Schwierigkeiten bei der Wirksamkeit der Schmutzentfernung als auch beim Ermitteln der Auswirkungen von Rückstande auf das Risiko einer mikrobiellen Kontamination im System. (siehe Abbildung 3)
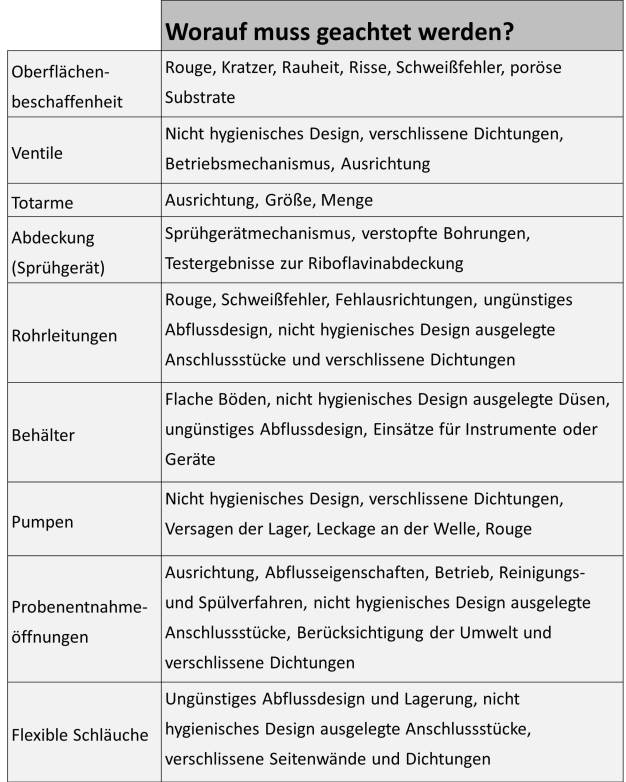
Oberflächen- und Prozessanlagendesign
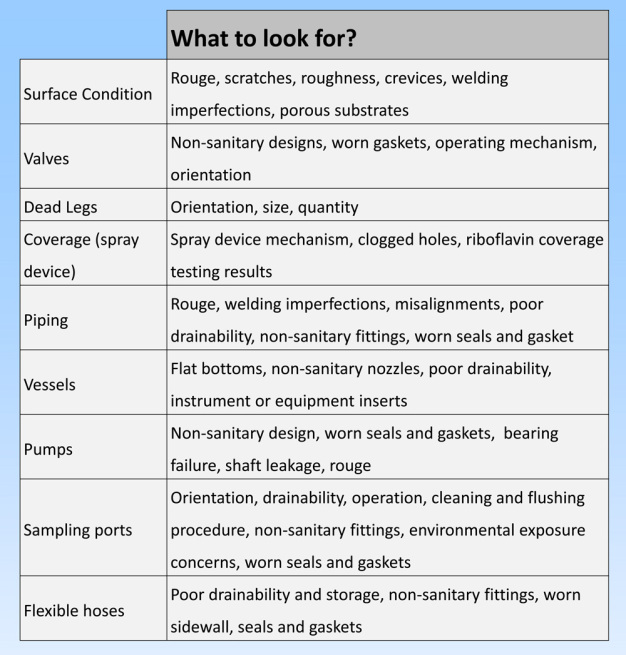
Die Oberflächenbeschaffenheit und das Anlagendesign können eine erfolgreiche Reinigung und mikrobielle Wirksamkeit begünstigen. Oberflächen-eigenschaften wie Rouge und Kalkablagerungen können chemisch entfernt werden. Für Kratzer, Risse und Korrosionen ist jedoch eine intensivere Wartung erforderlich. Prozessrückstände und Mikroorganismen haften meist hartnäckiger an einer ungleichmäßigen Oberfläche und lassen sich so schwieriger entfernen. Anlagendesignelemente wie Abdeckung, Durchfluss, Komponentenauswahl, Größe und Ausrichtung der Totarme, Ventilauswahl, Abfluss-eigenschaften sowie Gefälle der Rohrleitungen, sind ebenso wichtige Faktoren für eine erfolgreiche Reinigung und Desinfektion (Rivera, 2012, und Verghese, 2009). (siehe Abbildung 4)
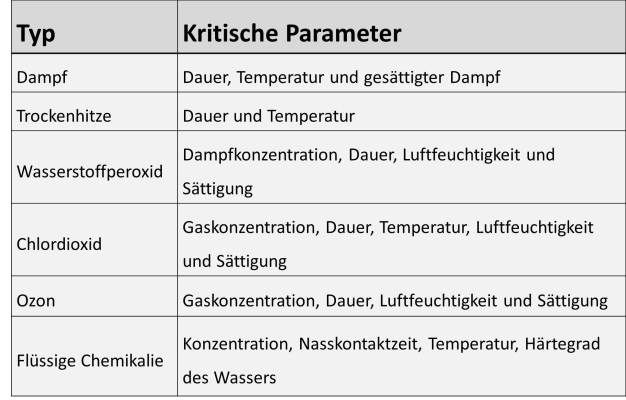
Sterilisations-/Desinfektionsparameter
Für die Desinfektion bzw. Sterilisation von Anlagen stehen mehrere Techniken zur Verfügung. Zu den Hochtemperatur-Sterilisationstechniken gehören SIP (Steam-In-Place = Dampf vor Ort) und Trockenhitze. Gas-/Dampftechniken umfassen Wasserstoffperoxidverdampfung, Chlordioxid und Ozontechniken. Eine chemische Sterilisation kann auch mithilfe handelsüblicher Sporizide/Desinfektions durchgeführt werden.
Im Falle von unsterilen Pharmazeutika ist die Sterilisation der Prozessanlagen weder erforderlich, noch wird sie erwartet. Im Allgemeinen ist eine niedrige und kontrollierte Keimzahl akzeptiert. Eine wirksame Reinigung, gefolgt von einem Desinfektions- oder Sterilisationsschritt, ist möglicherweise ausreichend, sofern dadurch unzulässige Mikroorganismen abgetötet werden. Referenzen, wie USP „Microbiological Attributes of Non-sterile Products“ (Mikrobiologische Eigenschaften unsteriler Produkte), geben Hilfestellungen bei der Definition und Festlegung mikrobiologischer Grenzwerte für fertige Produkte. Nichtsdesto-weniger muss die Bedeutung anderer Mikroorganismen für jeden Fall neu ermittelt werden. Bei diesen handelt es sich um mikrobielle Verschmutzungen, welche, abhängig von Spezies, Zellenanzahl, Arzneiform und Verwendungszweck des Medikaments, die Patientensicherheit beeinträchtigen könnten [USP 1111]. Die o. a. Methoden müssen validiert werden, um sicherzustellen, dass sie zuvor festgelegte Kriterien gleichbleibend erfüllen. Veränderungen beim Verschmutzungsgrad, bei der Mikroorganismusbelastung, der Spezies sowie bei Oberflächeneigenschaften können sich auf die eingesetzte Desinfektions- bzw. Sterilisationsmethode auswirken. Kritische Parameter, welche die Wirksamkeit dieser Methoden bestimmen, müssen regelmäßig überwacht werden, um den validierten Zustand zu überprüfen. (siehe Abbildung 5)
Schlussfolgerungen:
Die Kontamination eines Produkts mit einem unzulässigen Mikroorganismus stellt ein kostspieliges und zeitaufwendiges Problem dar, das schnell und effizient von einem bereichsübergreifenden Team angegangen werden muss. Es ist äußerst wichtig, dass die Mikroorganismen schon früh bei der Untersuchung ermittelt werden, damit festgestellt werden kann, ob sie aus einer intrinsischen (aus dem Produktionsprozess) oder extrinsischen (außerhalb des Produk-tionsprozesses) Quelle stammen. Ein sorgfältiges Überprüfen des Prozesses kann beim Bestimmen von Bereichen mit erhöhtem Risiko einer mikrobiellen Kontamination helfen. Außerdem können so das Vorhandensein bzw. Fehlen von Kontrollen, der Zeitpunkt des höchsten Risikos für das Produkt sowie Lösungen zur Risikominderung ermittelt werden. Zum Angehen der Kontaminationsproblematik wird gemeinhin ein ganzheitlicher Ansatz angewendet. Als Teil des ganzheitlichen Ansatzes müssen die Reinigungs-fähigkeit des Systems bewertet und Änderungen an dem Anlagendesign durchgeführt werden, um ggf. Problemen wie der Abdeckung, den Abflusseigenschaften usw. zu begegnen. Führen Sie zum Entfernen von Prozess- und mikrobiellen Rückständen eine wirksame alkalische Reinigung bei hoher Temperatur durch. Beim Auftreten von Rouge oder Kalkablagerungen muss eine Säurereinigung bei hoher Temperatur durchgeführt werden, um die anorganischen Rückstände zu entfernen. Verwenden Sie nach Möglichkeit ein Desinfektions-/Sterilisationsverfahren, das regelmäßig vor Ort durchgeführt wird. Stellen Sie außerdem sicher, dass während des Prozesses die kritischen Parameter erreicht werden. Sobald der Produktionsprozess wieder eingeleitet wurde und läuft, sollten regelmäßige Besprechungen anberaumt werden, um die aktuellen Maßnahmen zur mikrobiellen Kontrolle und die internen Pläne zu überprüfen, damit das nächste Auftreten einer mikrobiellen Kontamination schnell und wirksam adressiert werden kann.
Literaturangaben
- Bartnett, C., Polarine, J. und Lopolito, P. „Control Strategies for Fungal Contamination in Cleanrooms“. Controlled Environments, Sept. 2007.
- Rivera. E. „Basic Equipment Design Concepts to Enable Cleaning in Place“. Pharmaceutical Technology. http://pharmtech.findpharma.com/pharmtech/article/articleDetail.jsp?id=726190.
- Verghese, G. und Kaiser, N. (2009). Cleaning Agents and Cleaning Chemistry. Pluta, P (eds) Cleaning and Cleaning Validation Volume I, Davis Healthcare International and Parenteral Drug Association (2009), Kapitel 7, Seite 103–121.
- Verghese, G. und Lopolito, P. (2009). Cleaning Engineering and Equipment Design. Pluta, P (eds) Cleaning and Cleaning Validation Volume I, Davis Healthcare International and Parenteral Drug Association (2009), Kapitel 8, Seite 123–150.
STERIS Deutschland GmbH
50933 Köln
Deutschland